Gesunder Boden
Die Schwere des Bodens lässt sich nicht beeinflussen. Ein leichter, sandiger Boden lässt sich nicht zum schweren, tonhaltigen Boden machen und umgekehrt.
Viel wichtiger ist es, die Ressource Boden, die zur Verfügung steht, in einen idealen Zustand zu versetzen, um sie der Pflanze optimal nutzbar zu machen. Auch der Aufbau von Humus mildert die durch die Bodenart vorgegebenen Defizite.
Entscheidend ist dabei nicht nur die Zusammensetzung der pflanzennutzbaren Nährstoffe im Boden. Auch die Nährstoffe, die die Beschaffenheit des Bodens und den Lebensraum der nichtpflanzlichen Lebewesen beeinflussen, sind elementar.
Eine besondere Bedeutung kommt dabei der Kationenaustauschkapazität (KAK oder engl. CEC) zu.
KAK - KationenAustauschKapazität
Der Boden hat, je nach Beschaffenheit (leicht, sandig oder schwer, tonhaltig usw.), unterschiedliche Speicherkapazität für Nährstoffe wie Kalzium, Magnesium, Kalium und Natrium. Die genannten Nährstoffe liegen im Boden als positiv geladene Ionen (Kationen) vor.
Die Teilchen des Bodens (Humuspartikel, Tonminerale, Sand oder Staubkörnchen) sind ebenfalls elektrisch geladen, im Gegensatz zu den genannten Nährstoffen allerdings negativ (Anionen). Die negativ geladenen Bodenteilchen ziehen die gelösten, positiv geladenen Nährstoffe an und fixieren sie an ihren Oberflächen. Die Bindung an die Oberfläche ist dabei so stark, dass sich die Nährstoffe nicht wieder im Wasser lösen und somit auch nicht von der Pflanze genutzt werden können.
Die KAK ist also ein Maß für die Nährstoff-Speicherkapazität eines Bodens. Die richtige Belegung des verfügbaren Speicherplatzes macht ihn aber erst wertvoll, denn damit ist das chemische Gleichgewicht erreicht!
Was bedeutet das in der Praxis?
Gibt man Kationen (Ca++, Mg++, K+, Na+, H+) über eine Düngung in den Boden, werden diese von den negativ geladenen Bodenpartikeln angezogen. Sie docken daran solange an, bis genauso viele positive wie negative Ladungen am Bodenpartikel vorhanden sind, also ein elektrostatisches Gleichgewicht hergestellt ist.
Erst wenn dieses Gleichgewicht erreicht ist, also die Kolloide mit Kationen voll belegt sind, verbleiben, falls noch vorhanden, positive Ladungen und damit die Nährstoffe in der Bodenlösung. Sie sind somit für die Pflanze verfügbar.
Sind in der Bodenlösung sehr viele gelöste Kationen, wie z.B. nach einer Düngung, wird die Fixierung der an den Bodenpartikeln gebundenen Kationen schwächer. Mit Hilfe von Wasserstoff (H+) lösen sich einige Kationen und gehen in die Bodenlösung über, die frei werdenden Plätze werden von anderen Kationen wieder besetzt.
Doppelt positiv geladene Kationen wie Ca++ und Mg++ sind dabei durch einfach positiv geladen Teilchen wie K+ oder H+ kaum zu verdrängen. Sie haften durch die höhere elektrostatische Kraft zu fest an. Folgende Reihenfolge der Anziehungskräfte von schwach bis stark ist gültig: H+ > Na+ > K+ >Ca++ > Mg++.Magnesium ist also das am schwersten aus der Kolloid-Fixierung zu verdrängende Kation.
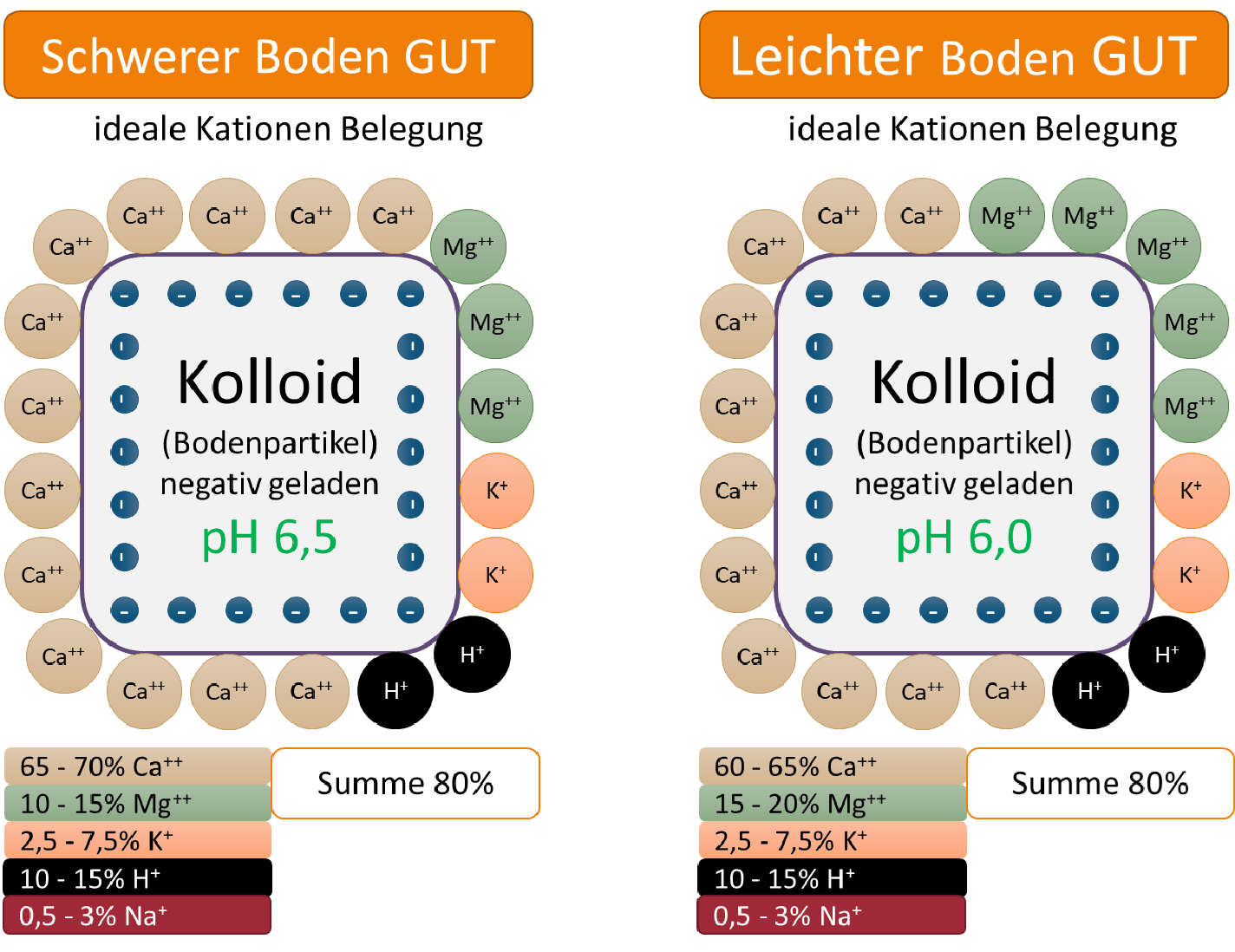
Magnesium und Kalzium Kationen können sich deswegen nahezu nur gegenseitig verdrängen, deswegen liegt dort der Fokus. Übersteigt die Summe beider Kationen nämlich den Wert von 80% aller Kationen, haben andere Kationen kaum mehr eine Möglichkeit am Sorptionskomplex (Verhältnis aller Kationen am Kolloid zwischen einander) mitzuwirken. Sie werden entweder in den Zwischenräumen der Kolloide fixiert, oder verbleiben in der Bodenlösung und sind dabei zwar pflanzenverfügbar, aber permanent auswaschungsgefährdet.
Liegt die Summe der Kalzium- und Magnesiumkationen bei 80% aller Kationen, befindet man sich im Idealzustand. Allerdings hängt dieser maßgeblich vom Verhältnis der beiden zueinander ab.
Man unterscheidet dabei zwischen schweren und leichten Böden. Bei schweren Böden sollten 65-70% aller Kationen Kalzium Kationen und 10-15% aller Kationen Magnesium Kationen sein. Bei leichten Böden verschiebt sich das ideale Verhältnis auf 60-65% Kalzium und 15-20% Magnesium Kationen. Die Basis für ein chemisches Gleichgewicht im Boden ist damit geschaffen.
Stundenboden
Bei Nässe schmierig und klebrig, bei Trockenheit steinhart, kaum bewirtschaftbar und mit tiefen, Ammoniak ausdünstenden Rissen.
Die Ursache hierfür ist extremer Magnesium Überschuss. Die doppelt positiv geladenen Mg++ Kationen binden, genauso wie die Ca++ Kationen, negativ geladene Tonpartikel aneinander.
Der Unterschied zwischen beiden besteht darin, dass die sie umgebene Wasserhülle im Falle von Magnesium wesentlich instabiler ist, als die bei Kalzium. Sie ändert sich bei schwankender Feuchtigkeit schnell.
Bei hoher Feuchtigkeit schwillt die Wasserhülle stark an und wirkt wie ein Gleitmittel. Der Boden wird glitschig, verdichtet und verschlammt bei Druck.
Nimmt die Feuchtigkeit ab, reduziert sich die Wasserhülle bei Magnesium schnell bis auf ein Minimum. Die Tonminerale werden durch die positive Ladung und die geringen Abstände des Mg++ zu den Tonpartikeln stark angezogen und damit fixiert. Der Boden wird hart.
Die Wasserhülle der Ca++ Kationen ist relativ stabil. Die Bindungsabstände zu den Tonteilchen bleiben konstant, der Boden behält seine Konsistenz.
Ist die Aufteilung der Ca++ und Mg++ nicht in diesem Verhältnis kommt es zu folgenden Problemen:
Variante 1: Zu hoher Magnesium Anteil
Zu viel Magnesium führt dazu, dass die Pflanze kurioserweise weniger Magnesium aufnimmt. Damit kommt es in der Pflanze zu Magnesiummangel. Magnesiummangel führt zu einer schlechten Stickstoffaufnahme und das sichtbare Mangelsymptom entspricht dem eines Stickstoffmangels. Gibt man Stickstoff, um den vermeintlichen Mangel auszugleichen, verschlechtert sich die Situation weiter, da der von der Pflanze nicht genutzte Stickstoff (Nitrat) zusätzlich Kalzium im Auswaschungsprozess aus dem Boden entfernt und das Missverhältnis zwischen Kalzium und Magnesium verstärkt.
Erst bei einem Anstieg des Kalziumgehalts in der Basensättigung auf ca. 60% ist der Boden so porös, dass das Magnesium über die Gabe von Schwefel aus dem Boden entfernt werden kann. Ohne eine Wasserbewegung im Boden häuft sich der Schwefel sonst einfach nur an.
Somit lässt sich ein zu hoher Magnesium Gehalt im Boden nur durch eine hohe Gabe von Kalzium und Schwefel reduzieren. Grundsätzlich reguliert Elementarschwefel und im Speziellen das beim Abbau von Elementarschwefel (S) entstehende SO4-, durch seine nachhaltige Wirkung, die überschüssigen Kationen!
Variante 2: Zu hoher Kalzium Anteil
Zu hoher Kalziumanteil in der Basensättigung führt zu hoher Porosität des Bodens. Der Boden kann die Nährstoffe nicht mehr halten, sie fließen zu schnell ab. Kalium und Magnesium werden durch Mangel in der Bodenlösung festgelegt.
Um den Bodenzusammenhalt wieder herzustellen, ist es erforderlich, den Magnesium Anteil zu erhöhen. Dies erfolgt über eine Düngung mit Magnesiumoxid bei gleichzeitiger Schwefelzufuhr. Über das negativ geladene Schwefelsulfat wird das überschüssige Ca++ gebunden und abgeführt.
Es ist generell anzumerken, dass über die Gabe von Schwefel immer das Kation gebunden und abgeführt wird, welches sich im Überschuss befindet.
Merke:
Schwere Böden haben eine hohe KAK, sie können damit wesentlich mehr pflanzenverfügbare Kationen als leichte Böden mit einer niedrigen KAK speichern.
Leichte Böden können erheblich weniger positiv geladene Nährstoffe (Kationen) speichern, belassen dafür mehr in der Bodenlösung. Diese sind damit aber wesentlich auswaschungsgefährdeter. Die Kationen stehen den Pflanzen in der Bodenlösung nach einer Düngung zwar in hoher Zahl zur Verfügung, werden aber auch in viel geringerer Anzahl fixiert und können damit nicht gespeichert werden.
Bei der Kalium Verfügbarkeit gibt es folgenden Punkt zu beachten:
- Bei sehr leichten Böden (Sandböden) kann, durch zu viel Kalium, Magnesium festgelegt werden.
- Bei sehr schweren Böden trifft das Gegenteil zu. Bei steigendem Magnesiumanteil wird Kalium festgelegt. Erst wenn der Magnesiumanteil sinkt, steigt auch die Kaliumverfügbarkeit wieder an.
Was ist wichtig?
Das Verhältnis der Anzahl der unterschiedlichen Kationen zueinander und nicht die Absolutgehalte sind entscheidend für den Erfolg einer Düngung. Böden mit einer hohen KAK haben zwangsläufig auch hohe Absolutgehalte an Nährstoffen. Diese sind jedoch fixiert und somit nicht pflanzenverfügbar.
Erst über Zuführung von Kationen, egal welcher Art, werden die gespeicherten Nährstoffe aus ihrer Fixierung gelöst. Welche Nährstoffe in welcher Dosierung zugeführt werden müssen, hängt vom Verhältnis der Anzahl der fixierten Kationen (Ca++, Mg++, K+ und Na+ (H+ und andere)) zueinander ab.
Als günstig haben sich folgende Verhältnisse herausgestellt:
 Weichen die Werte aus der Bodenuntersuchung von diesen Werten ab, sollten die Verhältnisse der einzelnen Kationen zueinander (vornehmlich Ca++ und Mg++) über entsprechende Düngung korrigiert werden. Der Absolutgehalt ist dabei irrelevant.
Weichen die Werte aus der Bodenuntersuchung von diesen Werten ab, sollten die Verhältnisse der einzelnen Kationen zueinander (vornehmlich Ca++ und Mg++) über entsprechende Düngung korrigiert werden. Der Absolutgehalt ist dabei irrelevant.
Zur Beseitigung eines Überschusses wird dringend Schwefel benötigt, um die überschüssigen Kationen zu entfernen. Ist das Kationenverhältnis zueinander ausgeglichen, muss die Schwefelzufuhr wieder auf das eigentlich erforderliche Maß (den Entzug durch die Pflanze) zurückgeführt werden.
Erst wenn das Kationenverhältnis zueinander ausgewogen ist, stehen die zusätzlich von der Pflanze benötigten, negativ geladenen, Nährstoffe (Sulfat, Nitrat, Phosphat usw.) vollumfänglich zur Verfügung.
